惠州市综合高级中学 高二年级 广东省惠州市 516000
摘要:水是生命之源,水质评价在人们日常生活中占有重要地位。本文介绍了有关水质评价的相关标准,利用分光光度法绘制标准曲线,测定自来水样品中铁离子的浓度。并且根据实验操作提出了相关的后续优化探究实验,总结实验过程中的误差。
关键词:分光光度法;铁离子的检验;优化实验方案;相关标准。
0引言
水是生命之源,在生产用水(需净化处理),冷却用水,生活用水和消防用水等方面上有重要用途。与此同时,用于生活方面的自来水中与人体健康密切相关,水中的部分金属元素,广泛存在于水和土壤中,它们更是在生物代谢中扮演着重要角色。人类在生活和生产活动中都离不开水,生活饮用水水质的优劣与我们的健康密切相关。以铁元素为例,人体中铁超标会加大心脑血管疾病的发病率,易得骨质疏松、肝硬化,肤色也会变暗,对心、肝、和胰产生损害,容易产生铁中毒或患癌症。由此可见,自来水中的铁元素无疑是人类的“双刃剑”。
由此观之,水质直接关系到人类健康,并在一起程度上标志着一个国家的文明程度和技术发展水平,因此各国都根据各自的情况,努力提高饮用水的水质并制定了相应的水质标准。但是饮用水标准是一定发展阶段的产物,并与生产力和水质分析手段的发展相适应。现行三大饮用水水质标准的特点WHO《饮用水水质准则》、EC《饮用水水质指令》、USEPA《美国饮用水水质标准》是目前国际上公认的先进、安全的水质标准,也是各国制定标准的基础或参照,而这三部标准由于建立和使用地区的经济发展、环境条件、科技力量等的差异而各具特点。而我国2012年7月1日出台的《生活饮用水卫生标准》对自来水中不同检测项目作出了严格标准化的要求。其中,对铁的检测标准是0.3mg/L。
本文介绍了相关水质检测方法,并通过分光光度法检测自来水中微量铁,提出相应的优化方案,总结实验过程中的误差。
1相关检测方法及分光光度法原理
现有的水质评价手段有化学滴定法、光谱法、质谱法和电化学法四个大类[1],其中有螯合滴定法,电感耦合,直接电位法,电位滴定法,伏安法,极谱法和比色法等。
1.1金纳米棒比色检测
自来水检测中一种常见的方法是金纳米棒比色检测[2]。
金纳米棒(GNRs)因其可调节的各向异性的光特性和较宽的光谱范围(从可见光区到近红外区)在生物化学传感领域有巨大的发展前景[2]。
向 GNRs 溶胶中引入过氧化氢这种氧化试剂的时候,GNRs的端面会被氧化,且GNRs的长径比和 LPAB 波长随着 H2O2氧化时间的延长逐渐变小。根据文献可知通过向 H2O2 中加入过渡金属离子产生羟基自由基能够提高其氧化能力,而亚铁离子对水氧化能力的提高在众多过渡金属离子中最为显著,因为亚铁离子与水可以形成具有强氧化性的芬顿试剂[4,5]。GNRs溶胶颜色随着氧化过程的进行发生规律 性变化,出现了一个较宽的色域包括酒红色、棕色、 绿色、蓝色、紫色、粉红色,不同氧化程度的 GNRs溶胶呈现出不同的颜色[6]。Fe2+与 H2O2 组成芬顿试剂,比其它离子(Na+, K+ , Li+ , Hg2+, Mg2+, Ni+ , Sn2+, Co2+, Cd2+, Cr3+, Zn2+, Ba2+, Cu2+,Fe3+)与水的组合的氧化性要强很多,在相同的实验条件下,Fe2+ 与 H2O2的组合具有更强的氧化性,使得 GNRs 溶胶率先到达色域中的下一个特征颜色。因此,通过观察样品颜色即可实现对 Fe2+的选择性检测和比色检测。
可以看出,金纳米棒比色检测在检测亚铁离子上具有检验准确度高,易于比对分析等特点。
1.2邻二氮菲分光光度法原理
在pH为2-9的溶液中,邻二氮菲与Fe2+反应生成稳定的橙红色络合物:
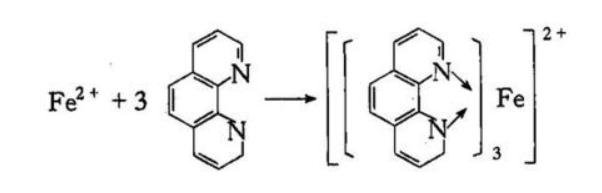
图1 邻二氮菲与Fe2+反应的示意图
若铁为正三价状态时,可用盐酸羟胺还原:
2Fe3++2NH2OH=2Fe2++2H++N2↑+2H2O
我们根据分光光度法——朗伯-比尔定律[7]利用紫外可见分光光度计测定铁标准工作液,计算吸光度后绘制标准曲线,再测定水样的吸光度即可得出溶液中相应离子的浓度。
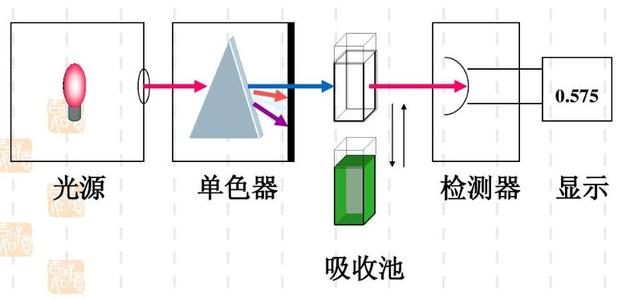
图2 分光光度法——朗伯-比尔定律的示意图
其中,透光度T= ( I/I0)×100%
吸光度A=- lgT = abc
a 吸光系数
b 吸收池厚度
c 溶液浓度
2实验部分
2.1仪器与试剂
实验仪器:紫外可见分光光度计,50ml比色管,分析天平,200ml容量瓶,1L容量瓶,烧杯,玻璃棒,对应浓度移液管。
实验试剂: 硫酸铁铵(NH4Fe(SO4)2·12H2O)、邻二氮菲(邻菲啰啉)、盐酸羟胺(NHOH·HCI)、无水醋酸钠(NaAc)、盐酸溶液(6 mol/L)。
2.2实验步骤
溶液配制:
铁标准储备液(100 ug/mL):准确称取0.863 g NH4Fe(SO4)2·12H2O,置于烧杯中,用20 mL盐酸溶液和纯水溶解后,定量转移至1L容量瓶中,用纯水稀释至刻度,摇匀。
邻二氮菲溶液(1.5 g/L):准确称取0.3g邻二氮菲置于200 mL容量瓶中,用纯水定容至刻度,摇匀。
盐酸羟胺(NH2OH·HCl)水溶液(100 g/L):准确称取10 g盐酸羟胺置于烧杯中,用适量纯水溶解后,定量转移至100 mL容量瓶,用纯水稀释至刻度,摇匀。
NaAc溶液(1 mol/L):准确称量16.4 g无水醋酸钠置于烧杯,加纯水溶解,转移到200 mL容量瓶中,定容到刻度,摇匀。
2.3标准曲线的绘制
配制铁标准工作液:用移液管吸取10mL铁标准储备液于100 mL容量瓶中,加入2mL盐酸溶液(6 mol/L),最后用纯水稀释至刻度,摇匀。此时溶液的质量浓度为10 ug/mL。
在6个50 mL的比色管中,分别加入 0、2 mL、4 mL、6 mL、8 mL、10 mL上述铁标准工作液,各加入1 mL盐酸羟胺溶液(100 g/L),摇匀。再加入5 mL 醋酸钠溶液(1 mol/L)和2 mL邻二氮菲溶液(1.5 g/L),用纯水稀释至刻度,摇匀。放置10 min后,用试剂空白为参比,在510 nm波长下,测定各溶液的吸光度,绘制标准曲线(c-A 曲线)。如下表 1 ,图3。
表1 510nm波长下标准样品浓度所对应的吸光度
标准铁离子浓度/mg/L | 吸光度平均值 |
0.412 | 0.077 |
0.824 | 0.158 |
1.236 | 0.242 |
1.648 | 0.324 |
2.060 | 0.403 |
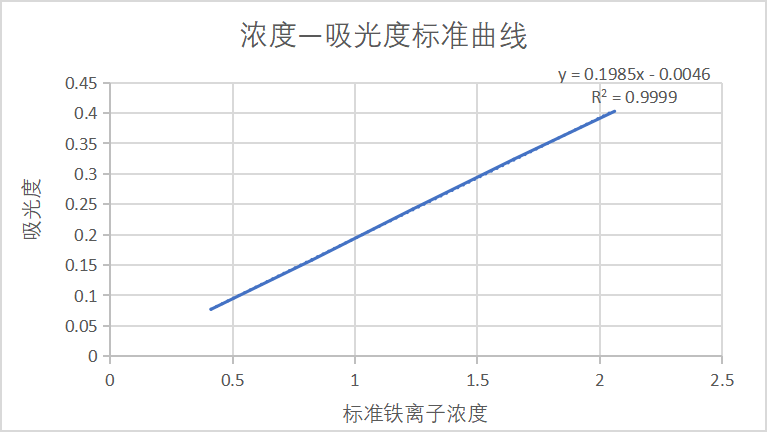
图3 浓度-吸光度标准曲线
3实验结果与讨论
3.1水样中含铁量测定
吸取5 mL水样3份,分别置于50 mL比色管中,各加入1mL盐酸羟胺溶液(100 g/L),摇匀。再加入5 mL醋酸钠溶液(1 mol/L)和 2 mL邻二氮菲溶液(1.5 g/L),用纯水稀释至刻度,摇匀。放置10 min后,用试剂空白为参比,在510 nm波长下,测定三份试样溶液的吸光度。
表2 自来水水样所对应吸光度
自来水水样 | 1 | 2 | 3 |
吸光度 | 0.001 | 0.002 | 0.001 |
吸光度平均值 | 0.001 | ||
将计算出的吸光度平均值y=0.001代入曲线y=0.1985x-0.0046,计算得水样中铁离子浓度为0.028mg/L,远小于国标中铁的检测标准,总而说明该水样中铁离子浓度为合格标准。
3.2优化探究方案
为尽量减小实验误差,达到最佳检测水平,笔者提出三个有关实验操作和测定的优化实验方案。
3.2.1还原剂(盐酸羟胺)浓度的选择
在6个50 mL的比色管中,分别加入 0、2 mL、4 mL、6 mL、8 mL、10 mL盐酸羟胺溶液(100 g/L),各加入1 mL铁标准工作液,摇匀。再加入5 mL 醋酸钠溶液(1 mol/L)和2 mL邻二氮菲溶液(1.5 g/L),用纯水稀释至刻度,摇匀。放置10 min后,用试剂空白为参比,在510 nm波长下,测定各溶液的吸光度 。将吸光度代入标准曲线计算铁离子浓度,与实际结果相对比。
3.2.2显色剂(邻二氮菲)浓度的选择
在6个50 mL的比色管中,各加入1 mL盐酸羟胺溶液(100 g/L),分别加入 0、2 mL、4 mL、6 mL、8 mL、10 mL邻二氮菲(1.5 g/L),各加入1 mL铁标准工作液,摇匀。再加入5 mL 醋酸钠溶液(1 mol/L),用纯水稀释至刻度,摇匀。放置10 min后,用试剂空白为参比,在510 nm波长下,测定各溶液的吸光度。将吸光度代入标准曲线计算铁离子浓度,与实际结果相对比。
3.2.3显色时间的选择
在5个50 mL的比色管中,分别加入1ml上述铁标准工作液,各加入1 mL盐酸羟胺溶液(100 g/L),摇匀。再加入5 mL 醋酸钠溶液(1 mol/L)和2 mL邻二氮菲溶液(1.5 g/L),用纯水稀释至刻度,摇匀。各放置0min,5min,10 min,15min,20min后,用试剂空白为参比,在510 nm波长下,测定各溶液的吸光度。将吸光度代入标准曲线计算铁离子浓度,与实际结果相对比。
3.3误差总结
实验过程中误差难以避免,这里总结以下两个方面的误差。
3.3.1仪器误差
实验过程中仪器读数的误差,如紫外可见分光光度计读数是否稳定,称量药品时分析天平读数是否稳定。
3.2.2人为误差
实验中加入盐酸羟胺溶液、邻二氮菲溶液的顺序。若顺序颠倒,则溶液中的部分三价铁离子可能无法完全转化为亚铁离子,导致测定结果所计算的铁离子浓度减小;在读数时对200mL容量瓶、1L容量瓶及50mL比色管定容时观察凹液面最低处时的俯视,仰视;称量药品时的操作误差,如选用的称装仪器;相关浓度移液管内壁残留水珠等。
4总结
本文总结了水的重要作用,介绍了相应国际标准、国家标准和几种相关的水质检测方法,根据分光光度法—朗伯-比尔定律,利用紫外分光光度计绘制铁离子的标准曲线,并测定水样中的铁离子浓度。提出相应的实验优化探究方案,总结实验过程中的误差。相信在科技不断发展的过程中,科研人员会不断改进研究方法,提高科研能力水平,为水质评价提供更好的方案,为人们的日常生活用水保驾护航。
参考文献
[1]郝雅萍,石佳颖.水中重金属元素的检测方法研究进展[J].化工时刊,2021,35:19.
[2]黄帅,刘显杰,游立.金纳米棒比色检测亚铁离子[J].船电技术应用研究,2019,39:43-44.
[3]郑淑静.金纳米棒的光学特性及生物检测应用研究[D]. 吉林: 东北师范大学, 2012
[4]Scheers N, Andlid T, Alminger M, et al. Determination of Fe2+ and Fe3+ in aqueous solutions containing food chelators by differential pulse anodic stripping
voltammetry[J]. electroanalysis. 2010, 22(10): 1090-10 96.
[5]Díaz T G, Guiberteau A, Soto M D L, et al. Spectrophotometric and adsorptive stripping square wave voltammetric determination of iron in olive oils, as complex with 5, 5-dimethylcyclohexane-1,2,3-trione 1,2-dioxime 3-thiosemicarbazone (DCDT)[J]. J Agric Food Chem. 2003, 51(13): 3743-3747.
[6]Liu J M, Wang X X, Jiao L, etal. Ultra-sensitive non-aggregation colorimetric sensor for detection of iron based on the signal amplification effect of Fe3+
catalyzing H2O2 oxidize gold nanorods[J]. Talanta. 2013, 116(1): 199-204.
[7]中国大百科全书总委员会《环境科学》委员会. 中国大百科全书, 环境科学[M]. 中国大百科全书出版社, 2002.