华北制药金坦生物技术股份有限公司 河北 石家庄 050000
摘要:目的 对生物学活性测定方法/MTT比色法进行方法优化。方法 以TF-1细胞为靶细胞,采用MTT比色法测定重组生物制品的生物学活性,并对其中TF-1细胞培养液中胎牛血清浓度、裂解液种类进行优化。结果 胎牛血清对TF-1细胞的增殖有促进作用,且在一定范围内浓度越大,促进作用越强。但在生物学活性测定时,胎牛血清会影响TF-1细胞对重组生物制品的依赖性,对活性测定结果造成干扰,影响实验敏感性。裂解液A和裂解液B作用后,生物学活性检测结果均在80% ~ 150%之间,但裂解液B溶解后不再出现沉淀,同时不会与残余的 MTT 发生反应,裂解液B过夜作用后检测A570/630nm及R2值明显高于裂解液A,且重复性好。
关键词: TF-1细胞;胎牛血清;MTT比色法;
目前检测重组生物制品活性的方法多采用 TF-1细胞/MTT 比色法[3],其原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。在一定细胞数范围内,MTT结晶形成的量与细胞数成线性关系,能定量反映细胞的生长状态和数量。该方法快速简便,能同时处理多个样品,并可定量检测。因此,MTT 比色法可用于细胞增殖速度及各种细胞因子活性的测定[4]。
细胞培养在整个生物技术产业的发展中起到了很关键的核心作用。细胞培养时培养基是关键,而培养基的构成中胎牛血清(fetal bovine serum FBS)对细胞的生长繁殖起着重要作用。所以胎牛血清质量的好坏直接影响着生物制品的质量和安全性。FBS是细胞培养中重要的天然培养基,含有丰富的细胞生长必须的营养成份,具有极为重要的功能。FBS成分很复杂,有的对细胞生长有促进作用,如提供基本的营养物质、激素和各种生长因子。但高浓度的血清物质会影响试验孔的光吸收值,导致试验本底增加,影响实验敏感性[5-6]。除此之外,TF-1 细胞/MTT 比色法中裂解液的种类也会影响测定结果。通常使用酸化的异丙醇溶解MTT 的还原产物甲臜,但是溶解不易充分,易在溶解后再次出现沉淀。也曾有文献报道,使用二甲基亚砜(DMSO)作为溶解剂,明显缩短了裂解时间,但其易与孔中残余的MTT发生反应,且呈剂量依赖性,导致背景值偏高,从而降低了灵敏度[7]。因此,本实验针对以上因素对 TF-1 细胞/MTT 比色法进行优化,以期为生产实践提供参考。
材料与方法
1.1细胞人红细胞白血病细胞(TF-1细胞)购自中国食品药品检定研究院。
1.2试剂及仪器 MTT购自德国Sigma公司;RPMI1640培养基及胎牛血清购自美国Gibco公司;96孔细胞培养板购自美国Costar公司;酶标仪购自瑞士Tecan公司。
1.3溶液的制备
1.3.1 标准品溶液 取标准品,用基础培养液复溶后,稀释至20IU/ml。
1.3.2 MTT溶液 取MTT粉末0.1g,溶于20ml PBS中,配制5mg/ml溶液,经0.22ųm滤膜过滤除菌,4℃避光保存。
1.3.3 培养液 基础培养液:胎牛血清:RPMI 1640培养液比例为1:9;完全培养液:基础培养液中加入其依赖因子至终浓度为5.0ng/ml或80IU/ml。
1.3.4裂解液 裂解液A:量取盐酸14ml,Triton X-100溶液50ml,加入异丙醇配制成500ml溶液;裂解液B:10%SDS溶液。
1.4 培养条件 将TF-1细胞用完全培养液于37℃ 5% CO2条件下培养,控制细胞浓度为(2.0~7.0)*105个/ml,传代后24~36h用于生物学检测。
1.5胎牛血清对TF-1细胞增殖的影响
1.5.1 细胞悬液的制备取TF-1细胞培养物于离心管中,3500rpm,离心5min,用RPMI 1640培养液清洗细胞3次,每次3500rpm,离心5min,然后用RPMI 1640培养液制备成含4.0*105个/ml细胞悬液。
1.5.2备板及细胞培养将不同浓度的基础培养基加入96 孔细胞培养板中,每孔 50μl,至血清终浓度分别为 0%、5%、10%、15%、20%、40%,每组设8个复孔。加好后用封口膜将细胞板封严,置37℃ 5% CO2条件下培养48小时。
1.5.3 加入MTT及显色用多道移液器每孔加入20μl MTT溶液,37℃ 5% CO2条件下培养4小时,用多道移液器每孔加入100μl裂解液并吹匀,然后放入酶联仪于570/630nm处测定吸光度,构建生长曲线,并分析统计学差异。
1.6胎牛血清对生物学活性测定的影响
1.6.1细胞悬液的制备 按照1.5.1的方法,同时用RPMI 1640培养液和基础培养液清洗细胞并制备细胞悬液。
1.6备板及细胞培养 取96孔板,用多道移液器分别加入RPMI 1640培养液和基础培养液,50ųl/孔。然后加入用基础培养液稀释好的标准品和样品溶液,做2倍系列稀释,共8个稀释度,每个稀释度2个复孔,50ųl/孔。分别将制备好的细胞悬液混匀倒入贮液槽中,用吸管边吹匀边用多道移液器加入细胞板中,每孔加入50μl均匀的细胞悬液,加好后用封口膜将细胞板封严,置37℃ 5% CO2条件下培养48小时。
1.6.3加入MTT及显色 操作同上1.5.3 利用酶联仪软件于570/630nm处测定吸光度,采用四参数回归计算法进行曲线拟合并计算生物学活性。
1.7 不同裂解液显色效应的比较 按照1.6的方法,只用RPMI 1640培养液清洗及制备细胞悬液。加入MTT培养4h后,分别加入裂解液A(吹匀,然后测定吸光度值)和裂解液B(过夜,然后测定吸光值),100ųl/孔。用酶联仪于570/630nm处测定吸光度,利用酶联仪软件,采用四参数回归计算法进行曲线拟合并计算生物学活性,比较细胞增殖梯度及生物学活性。
2. 结果
2.1不同体积浓度血清对TF-1细胞增殖的影响
体积浓度为 5%、10%、20%、30%、40%血清培养液对TF-1细胞的增殖有促进作用,且在一定范围内浓度越大,促进作用越强。与无血清的培养液组相比,差异有统计学意义(P<0.05)见图1。
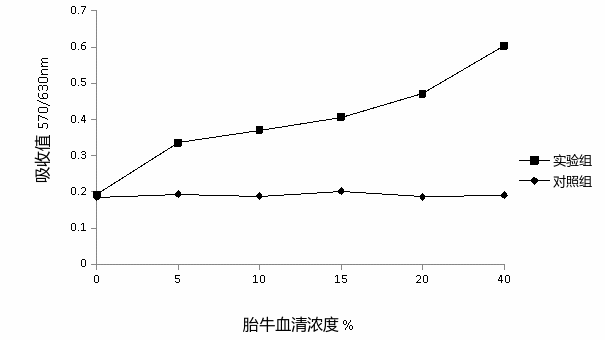
图1不同体积浓度血清培养后 TF-1 的生长曲线
2.2胎牛血清对生物学活性测定的影响
检测结果显示,当用基础培养液清洗、制备细胞悬液并培养细胞时,细胞增长梯度不到0.1,曲线未成明显的“S”型且R2值较低,测得样品的活性在 80% ~ 150%之间,但结果不稳定,见图2。当用RPMI1640培养液清洗、制备细胞悬液并培养细胞时,细胞增长梯度为0.2左右,曲线成明显的“S”型且R2值较高,R2>0.950,测得样品的活性在 80% ~ 150%之间,结果较稳定,见图3。

图2 基础培养液测定生物学活性曲线
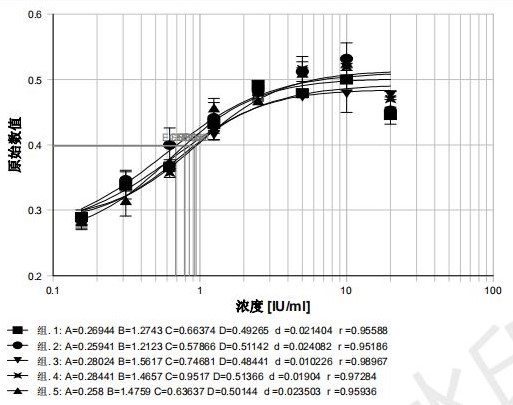
图3 RPMI1640培养液测定生物学活性曲线
2.3不同裂解液显色效应的比较
检测结果显示,裂解液A作用后立即检测,生物学活性在 80% ~ 150%之间,结果较稳定;裂解液B过夜作用后检测,生物学活性均在 80% ~150%之间,结果稳定,且细胞生长梯度增加0.1左右,曲线成明显的“S”型且R2值较高,R2>0.980,裂解液B过夜作用后检测A570/630nm及R2值明显高于裂解液A。见图3、图4。
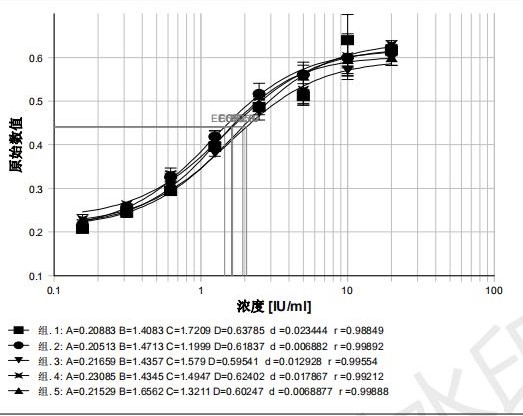
图4 裂解液B测定生物学活性曲线
3. 结论与讨论
生物学活性检测目前主要采用TF-1细胞/MTT比色法。在TF-1细胞/MTT比色法测定生物学活性的影响因素中,细胞对重组生物制品的依赖性和甲臜的溶解度直接关系着试验的灵敏度。FBS对TF-1细胞的增殖有促进作用,且在一定范围内,浓度越大,促进作用越强,高浓度的血清物质会影响试验孔的光吸收值,导致试验本底增加,影响实验敏感性。因此,在生物学活性测定时,FBS会对活性测定结果造成干扰。本实验中细胞培养时FBS浓度分别为10%和3.33%,与3.33% FBS相比,10% FBS培养细胞时,促进了细胞生长,影响了细胞对重组生物制品的依赖性,从而降低了实验的灵敏性。
MTT 的还原产物甲臜使用酸化的异丙醇溶解不易充分且溶解后易再次出现沉淀。使用二甲基亚砜(DMSO)作为溶解剂,虽然明显缩短了裂解时间,但其易与孔中残余的MTT发生反应,且呈剂量依赖性,导致背景值高,降低了实验的灵敏度[7]。本实验中分别采用裂解液A和裂解液B溶解MTT进行数据比对,裂解液A和裂解液B作用后,生物学活性检测结果均在80% ~ 150%之间,但裂解液B溶解后不再出现沉淀,同时不会与残余的 MTT 发生反应,且裂解液B过夜作用后检测A570/630nm及R2值明显高于裂解液A,所以裂解液B为最佳裂解液。
本实验以TF-1细胞/MTT比色法为基础,参考白介素-2(IL-2)生物学活性测定方法[3],对FBS对细胞的影响及裂解液显色效应进行优化,最终优化了生物学活性测定方法(TF-1 细胞/MTT 比色法)。结果显示FBS对TF-1细胞的增殖有促进作用,且浓度越大,促进作用越强。因此,在生物学活性测定时,高浓度的胎牛血清可能会影响TF-1细胞对重组生物制品的依赖性,降低实验的灵敏性。采用10%的 SDS 作为裂解液,裂解过夜后加入 MTT 显色4h,其四参数曲线R2值比 Triton裂解液更接近1,且结果重复性好。而使用 Triton 裂解时,如果适当延长裂解时间,结果也在可接受范围内,但该裂解液中含有盐酸、异丙醇等,易使蛋白质变性沉淀或对酶标仪造成腐蚀,所以优先选用10%的SDS。本实验优化后的检测方法不仅节约了FBS的用量,提高了检验的灵敏度,还为重组生物制品的生物学活性测定提供参考。
参考文献
[1]Burgess AW,Begley CG,Johnson GR,et al. Purification andproperties of bacterially synthesized human granulocyte-macro-phage colony stimulating factor[J]. Blood,1987,69(1):43-51.
[2]李北兵,白明,杨莹. 重组人粒细胞-巨噬细胞集落刺激因子的研究进展综述[J]. 黑龙江医药,2010,23(3):407-408.
[3]Chinese Pharmacopoeia Commission. Pharmacopoeia of People'sRepublic of China(Vol Ⅲ)[S]. Beijing:China Med Sci Press,2010.(in Chinese)国家药典委员会. 中华人民共和国药典(三部)[S]. 北京:中国医药科技出版社,2010.
[4]张冬梅,施晓青,朱洁,等. MTT 比色法在检测重组人 GM-CSF 生物活性中的应用[J]. 南京大学学报(自然科学),1997,33(2):253-258.
[5]Lanza RP,Cibelli JB,Blackwell C,et al.Extention od cell lifespan and telomere length in animal cloned from senescent somatic cell[J].Science,2000,288: 665-669.
[6]吴宏梅,刘帅,包阿东,等.不同胎牛血清对动物细胞体外培养的影响[J].中国畜牧兽医,2009,34( 4) : 96-99.
[7]彭涛,刘晓波,田伏洲,等. MTT 比色法中应采用分析纯二甲基亚砜作为臢溶解剂[J]. 中国免疫学杂志,1999,15(4):180.